


 邻近标记
邻近标记
 蛋白实验服务
蛋白实验服务
 组学服务
组学服务
 细胞培养服务
细胞培养服务
 细胞功能检测服务
细胞功能检测服务
 病毒包装服务
病毒包装服务
 外泌体服务
外泌体服务
 检测服务
检测服务
 基因编辑服务
基因编辑服务
 载体构建服务
载体构建服务
 动物实验服务
动物实验服务
 整体实验服务
整体实验服务
 科研绘图
科研绘图
 仪器共享
仪器共享
 伯远知识库
伯远知识库
 下单说明
下单说明
背景说明
在药物发现与化学生物学研究中,高效、可靠地鉴定小分子与靶蛋白之间的相互作用是贯穿始终的核心环节。传统的生物物理技术,如表面等离子共振(SPR)、等温滴定量热法(ITC),虽能提供精确的结合动力学与热力学参数,但其通量较低、成本高昂、样品消耗量大,难以应对早期海量候选化合物的快速初筛需求。因此,领域内亟需一种能够快速验证结合事件、指导先导化合物优化的高通量筛选方法。
在此背景下,热稳定性分析(Thermal Shift Assay, TSA)应运而生。该方法亦被称为差示扫描荧光法(Differential Scanning Fluorimetry, DSF),其原型理念源于蛋白质化学中对蛋白质稳定性的研究。随着实时荧光定量PCR(qPCR)仪的普及和专用荧光染料的开发,TSA凭借其惊人的简易性、低成本和高通量优势,迅速成为制药公司及学术实验室在药物筛选中不可或缺的“守门员”技术。它的核心价值在于能够间接但快速地指示小分子与靶蛋白的结合,为后续更精细的确认实验提供关键依据,极大地加速了药物研发的进程。
TSA的建立基于一个经典的生物物理化学原理:蛋白质的稳定性与其配体结合状态密切相关。
1.蛋白质热变性与熔解温度(Tm)
蛋白质的功能依赖于其独特的三维空间折叠构象(天然态)。当环境温度升高时,维持蛋白质高级结构的非共价键(如氢键、疏水作用、离子键)被破坏,导致蛋白质有序结构解开,失去活性,这一过程称为“热变性”。使50%的蛋白质分子发生变性的特征温度,即为该蛋白的熔解温度(Tm)。Tm是衡量蛋白质热稳定性的关键指标;Tm 值越高,表明该蛋白在热力学上越稳定。
2.小分子结合的稳定化效应
当一个小分子配体(如药物候选化合物)高亲和力地结合到靶蛋白的特定结合口袋(如活性中心或别构位点)时,它会与氨基酸残基形成一系列新的非共价相互作用网络(如氢键、范德华力)。这些相互作用如同“分子胶水”,将蛋白质的局部或整体结构“锚定”在更紧致的折叠状态,从而提高了蛋白质发生变性所需的能量势垒。其宏观表现就是,与配体结合的蛋白质,其Tm值会显著高于未结合(Apo)状态,即发生正向的“热位移”(ΔTm > 0)。
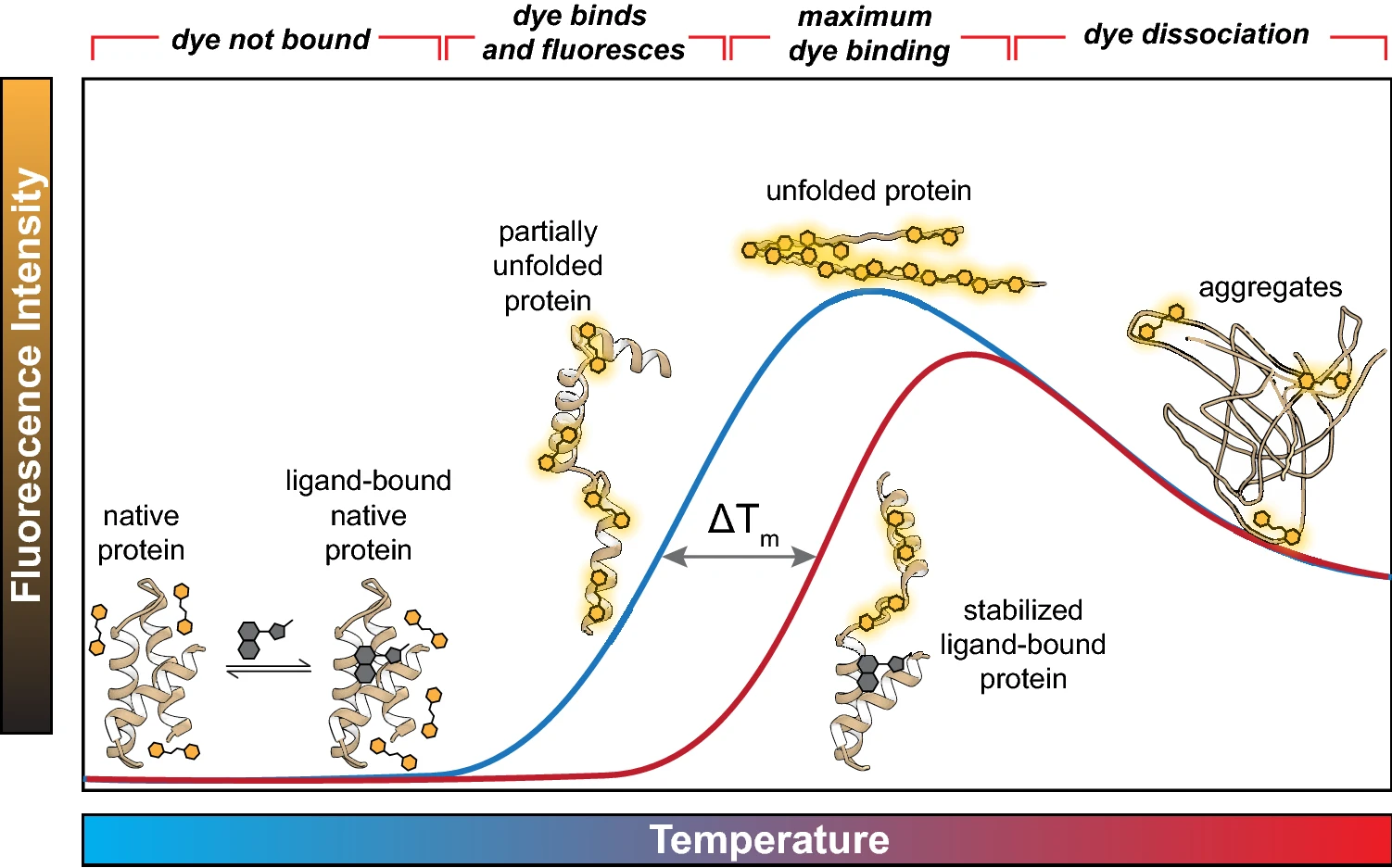
图1 TSA技术原理(Samuel et al., 2021)。
服务流程
客户在线下单——目标蛋白表达纯化——药物处理——qPCR仪温度梯度检测——图像处理及数据分析
服务内容及说明
适用范围
1、药物靶点验证与筛选;
2、研究结合机制与条件优化;
3、天然产物靶点发现。
客户下单及项目信息填写
在我司官网http://www.biorun.com/进行注册或登录,请客户按照页面提示填写:
1、项目名称、选择项目类型、填写个人信息及联系方式进行预提交;
2、提交项目所需要的具体信息:细胞样本、目标蛋白及对应的一抗等。
实验信息
实验过程中客户可以随时登入管理系统查看项目实时进展情况。实验结题时系统会通过短信自动通知客户,并发送实验报告查看网址。实验结题后,实验报告,检测结果可在线查看或打印,并永久保留。
实验周期
致电详询。
实验交付内容
1、目标蛋白的SDS-PAGE电泳图;
2、完整的实验数据及实验报告。
案例展示
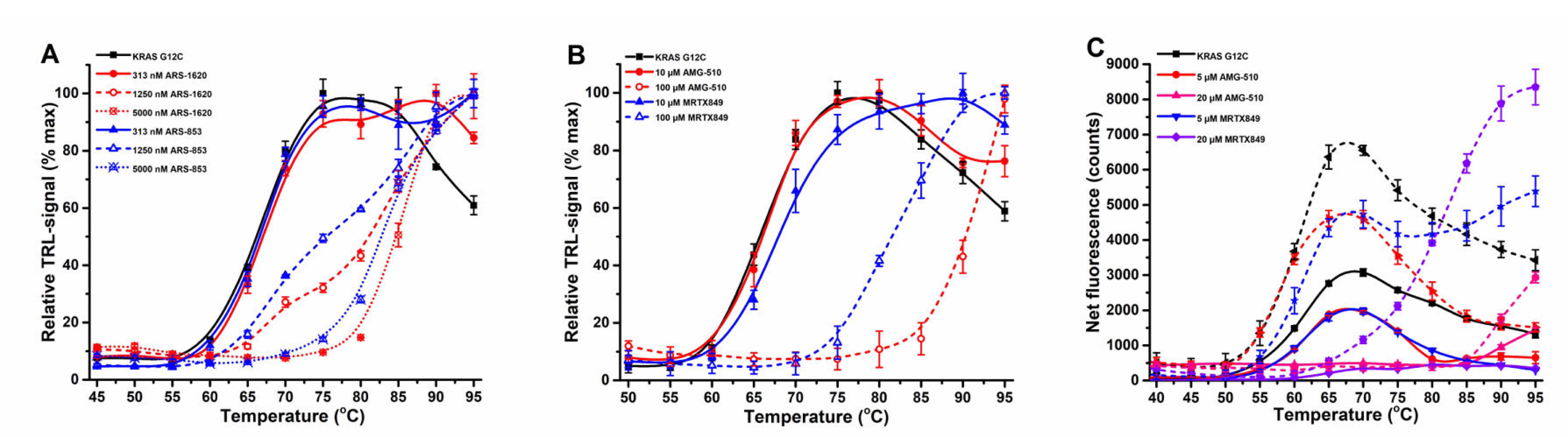
图2 共价KRAS G12C抑制剂在KRAS热稳定性分析中的应用(Kopra et al., 2022)。
参考文献
Kopra K, Valtonen S, Mahran R, et al. Thermal shift assay for small GTPase stability screening: evaluation and suitability[J]. International journal of molecular sciences, 2022, 23(13): 7095.
Samuel E L G, Holmes S L, Young D W. Processing binding data using an open-source workflow[J]. Journal of Cheminformatics, 2021, 13(1): 99.