

背景说明
在AAV研究的前15-20年中,AAV的几个重要方面被表征,包括其基因组构型和组成、DNA复制和转录、感染潜伏期和病毒粒子组装。现如今,重组AAV(rAAV)已成为体内基因治疗递送的主要平台。第一种rAAV基因治疗产品是uniQure公司的alipogene tiparvovec(Glybera),于2012年被欧洲药品管理局(EMA)批准用于治疗脂蛋白脂肪酶缺乏症;2018年,FDA批准了voretigene neparvovec-rzyl(Luxturna),这是第一个获得美国许可的rAAV基因疗法。
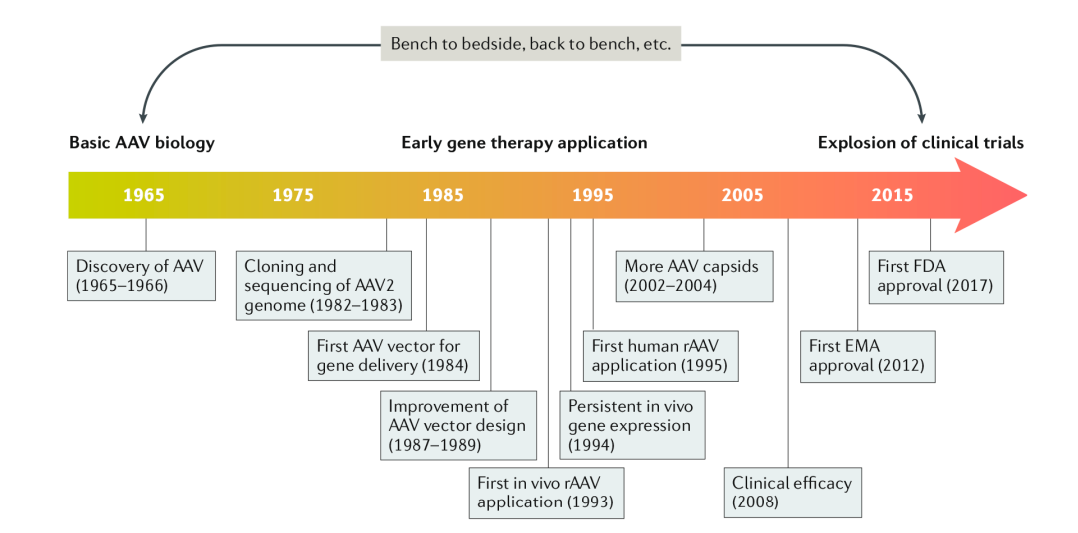
图 50年AAV时间线(Wang D, et al.2019)。
原理简介
AAV属微小病毒科(parvovirus),为无包膜的单链线状DNA病毒,目前的共识认为AAV不会引起任何人类疾病。
AAV由直径约26nm的二十面体蛋白质衣壳和约4.7kb的单链DNA基因组组成。衣壳包含VP1、VP2和VP3三类亚基,共60种拷贝,比例为1:1:10(VP1:VP2:VP3)。基因组的两端是两个T形反向末端重复序列(ITR),其末端主要用作病毒复制起点和包装信号,其中,Rep基因编码4个重叠的多功能蛋白,并以其分子量命名为Rep78、Rep68、Rep52和Rep40,其中Rep78与Rep68参与AAV的复制与整合,Rep52和Rep40具有解螺旋酶和ATP酶活性,与Rep78、Rep68共同参与单链基因组的复制;Cap基因编码VP1、VP2、VP3,在AAV病毒整合、复制和装配中其重要作用;编码组装活化蛋白(AAP)的第三个基因在不同开放阅读框(ORF)中的cap编码序列内编码,并且可促进病毒粒子组装。
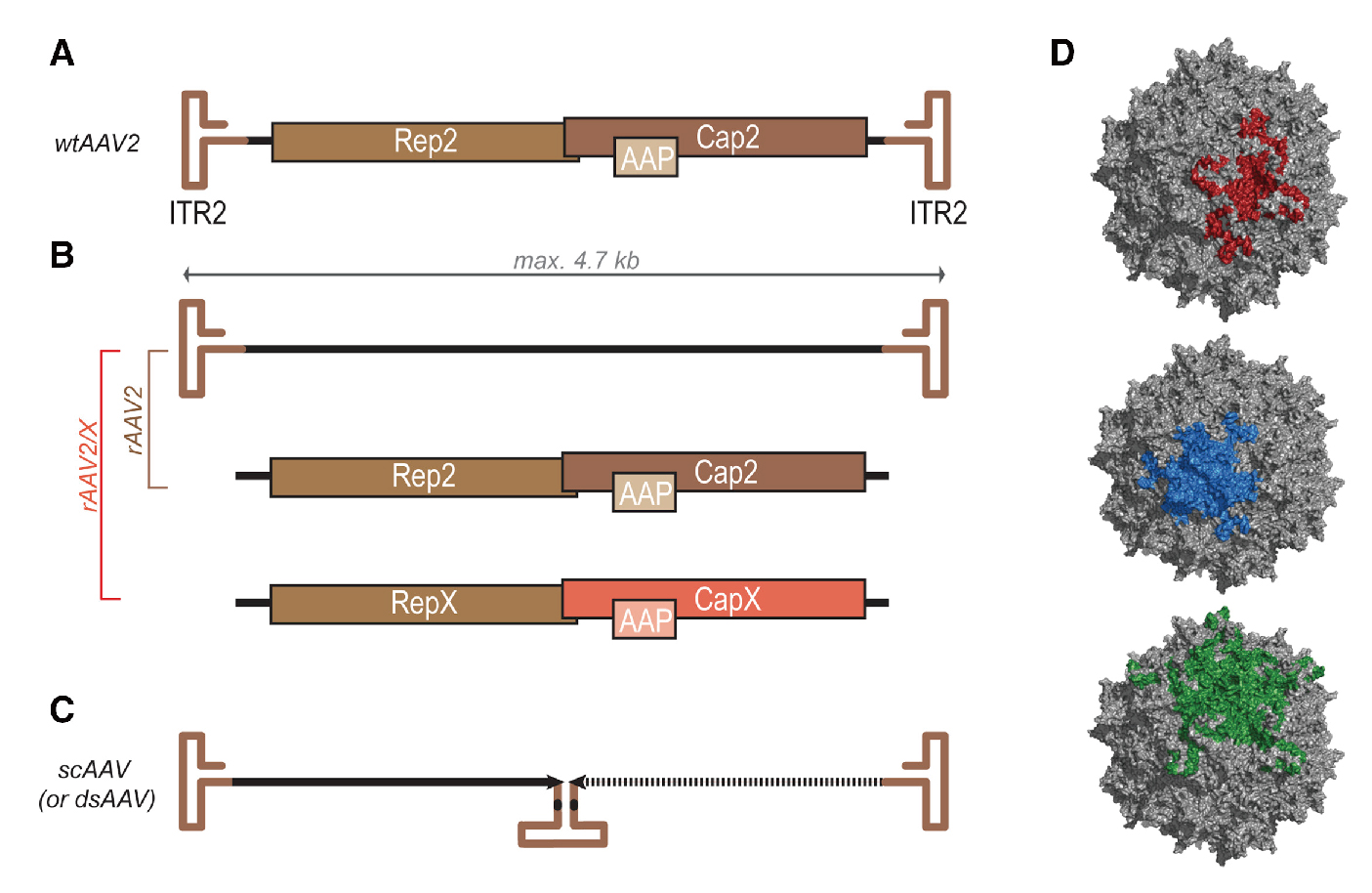
图 AAV基因组结构(Hudry et al. 2019)。
AAV基因组可以整合到人类细胞中称为AAVS1的基因组基因座中以建立潜伏期。由于AAV具有宿主范围广、安全性高、免疫原性低、表达稳定和物理性质稳定等优点,已被广泛应用于基础研究和临床试验中,并且AAV载体已成为世界上最常用的基因治疗载体之一。
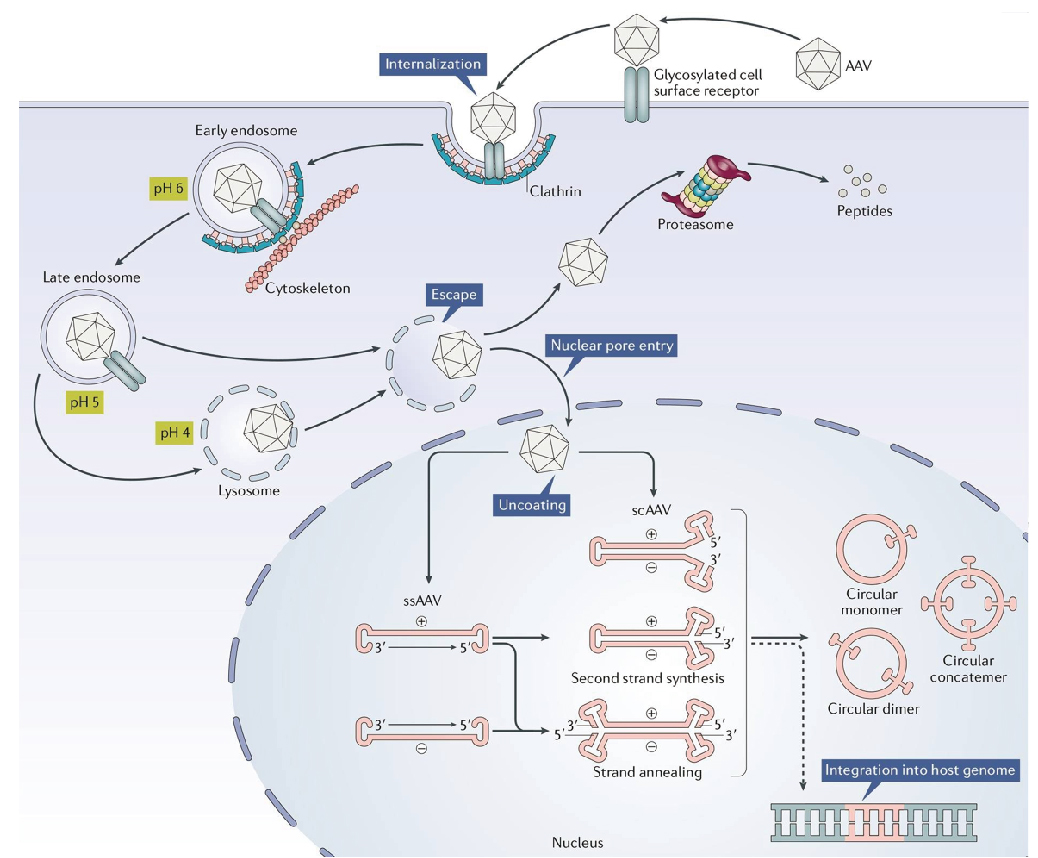
图 rAAV转导通路(Wang D, et al.2019)。
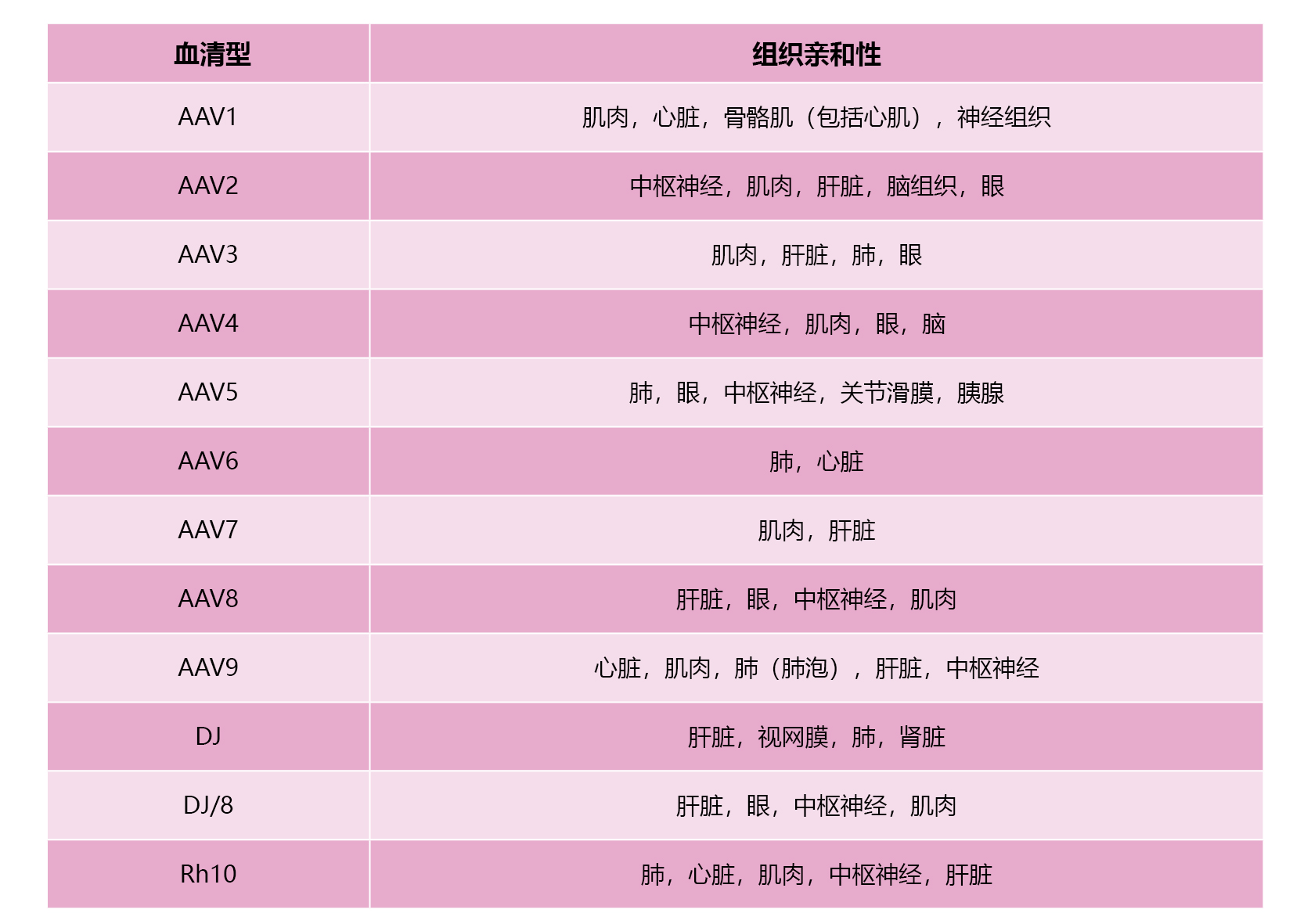
目前AAV有多种血清型,不同的血清型对组织或器官有着不同的亲和性,因此对不同的组织和细胞的转染效率存在差异。其中AAV2、AAV3、AAV9源自人类本身,是迄今研究最为彻底、应用最为广泛的AAV载体。
表 不同血清型AAV对各组织器官细胞的亲和性
各病毒载体生物学特性比较
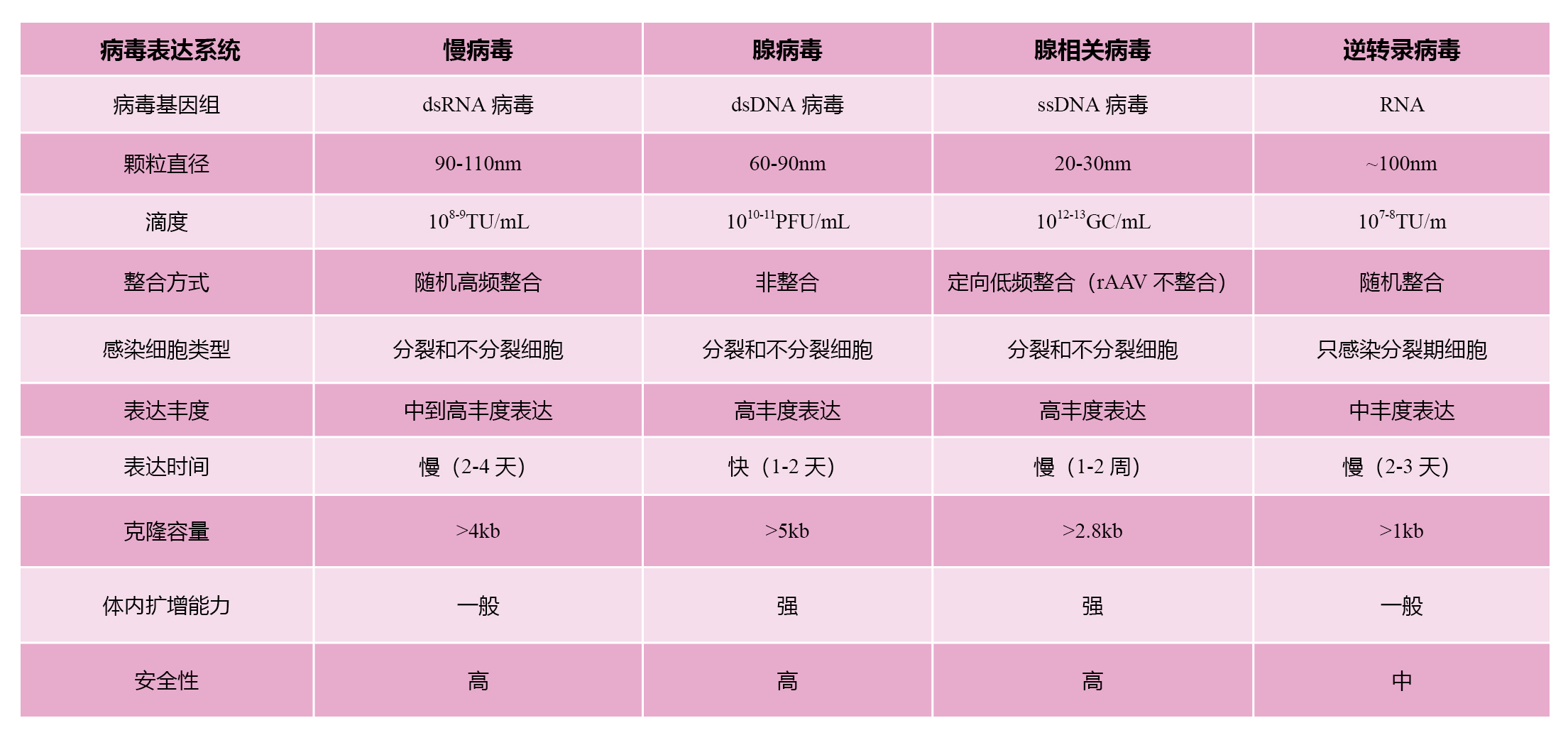
表 不同病毒的生物学特性比较
我司载体简介
我司AAV血清型种类齐全,可提供AAV1-AAV9以及DJ、DJ/8、Rh10等12种血清型,而且还可包装双链AAV(scAAV)。
我司AAV载体有CMV、mCMV、CAG、PGK、RK1、EF1a、GFAP等多种启动子可供选择;而且还有EGFP、ZsGreen、tdTomato、mCherry、EYFP等多种荧光标记蛋白可供选择;同时可以提供诱导型AAV病毒的包装,如Tet-On系统等。
我司原始细胞腺相关病毒包装载体列表,可根据不同的需求,选择不同的载体,插入不同的位置
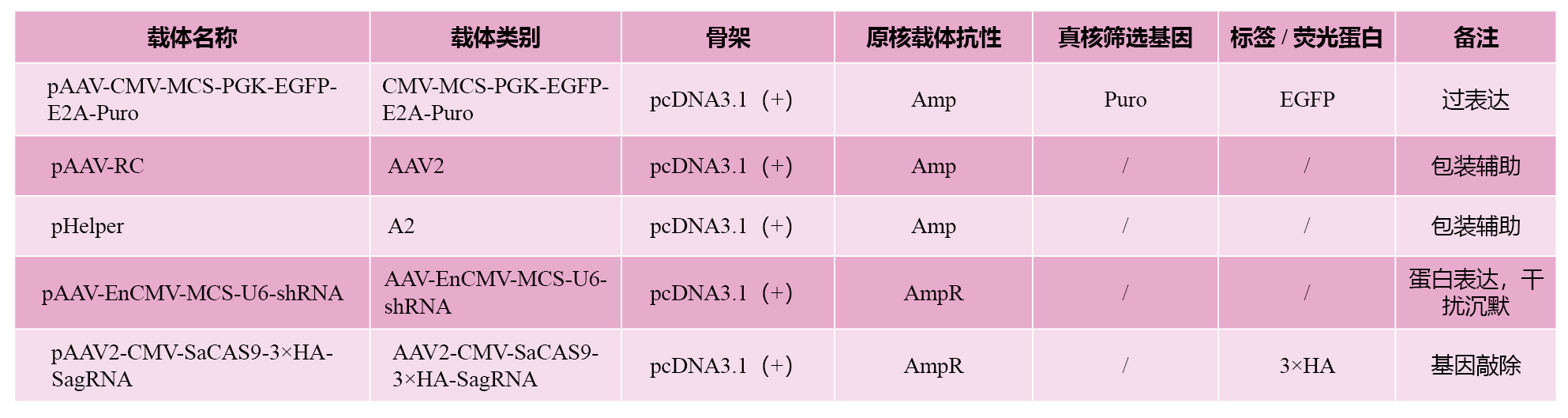
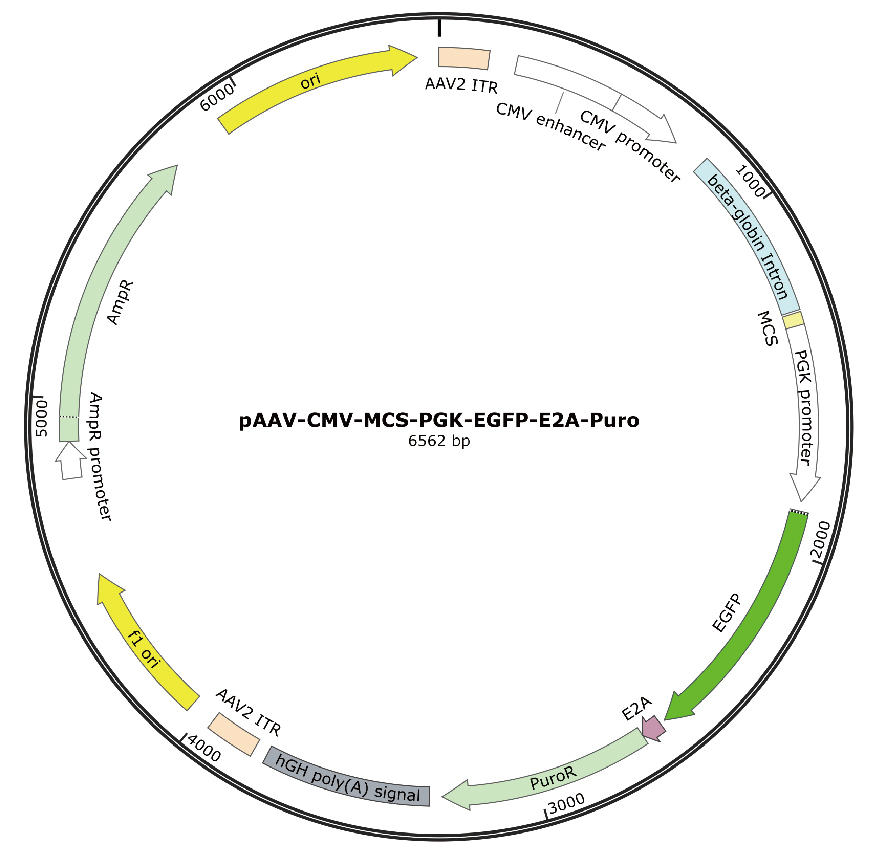
图 原始商品化腺相关病毒载体
服务内容及说明
适用范围
可用于多种疾病的基因治疗研究(包括体内、体外实验);同时作为一种有特点的基因转移载体,广泛用于基因功能研究、构建疾病模型、制备基因敲除鼠等方面。
客户下单及项目信息填写
在我司官网http://www.biorun.com/进行注册或登录,请客户按照页面提示填写:基因名称(注明过表达或干扰)、基因ID、序列等信息,细胞可选自行提供或我司提供。
实验信息
实验过程中客户可以随时登入管理系统查看项目实时进展情况。实验结题时系统会通过短信自动通知客户,并发送实验报告查看网址。实验结题后,实验报告、检测结果可在线查看或打印,并永久保留。
实验周期
致电详询
实验交付内容
1、所有实验的原始数据(包括实验过程、实验试剂与设备等);
2、重组载体的全序列信息和注释信息;
3、重组载体的酶切图谱;
4、重组载体测序结果;
5、引物序列;
6、病毒质控鉴定报告与结果分析(包含滴度鉴定、BCA检测、支原体检测等可选);
7、1mL高滴度AAV载体(不低于1011GC/mL);
8、0.1mL阴性对照病毒(不低于1011GC/mL)。
AAV的优点
1、安全性高。迄今从未发现野生型AAV对人体致病,重组AAV基因组序列上去除了大部分的野生型AAV基因组元件,进一步保证了安全性;
2、免疫原性低。当AAV用局部大剂量感染肌肉、脑、眼等组织时,很少有感染上的细胞之后被免疫系统所清除,对动物实验极有帮助;
3、宿主范围广。几乎所有处于分裂期和静止期的细胞都可用AAV感染;
4、表达稳定、持续时间长。可在宿主细胞中形成附加体(episome)存在于细胞核中,在细胞分裂不旺盛的组织中可持续表达5个月以上;
5、扩散性强。rAAV具有远高于AdV和LVs的扩散性,可以穿透血脑屏障,是最理想的神经元和胶质细胞感染工具;
6、物理性质稳定。可使用冰袋运输,在60℃不被灭活,能抗氯仿;
7、特异性强。rAAV有十数种常用的血清型,不同的血清型对不同的脏器有较高的识别及感染能力。
文献示例
案例一:AAV2感染肝脏
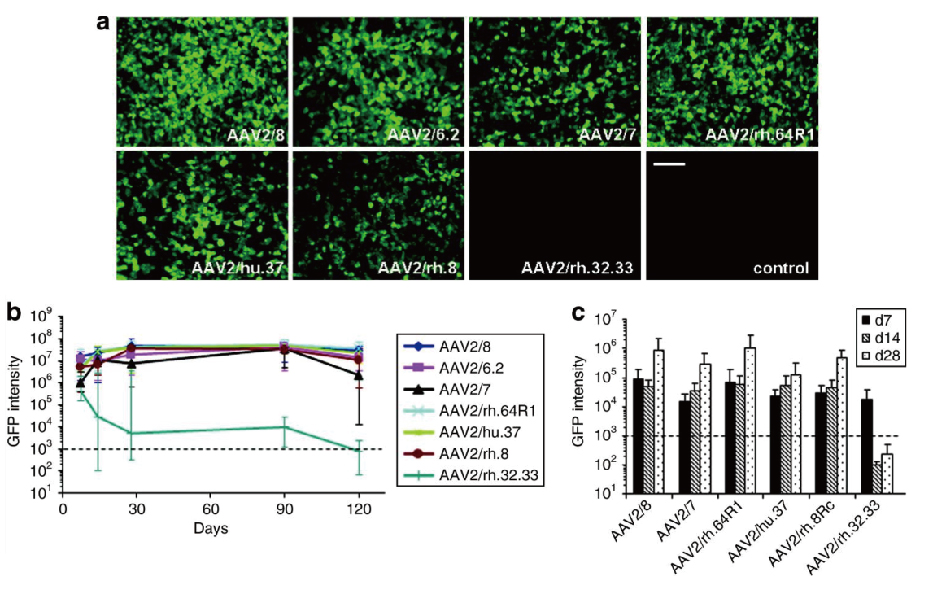
图 小鼠肝脏中AAV2介导的转基因表达(Wang L, et al. 2010)。
案例二:AAV感染心脏
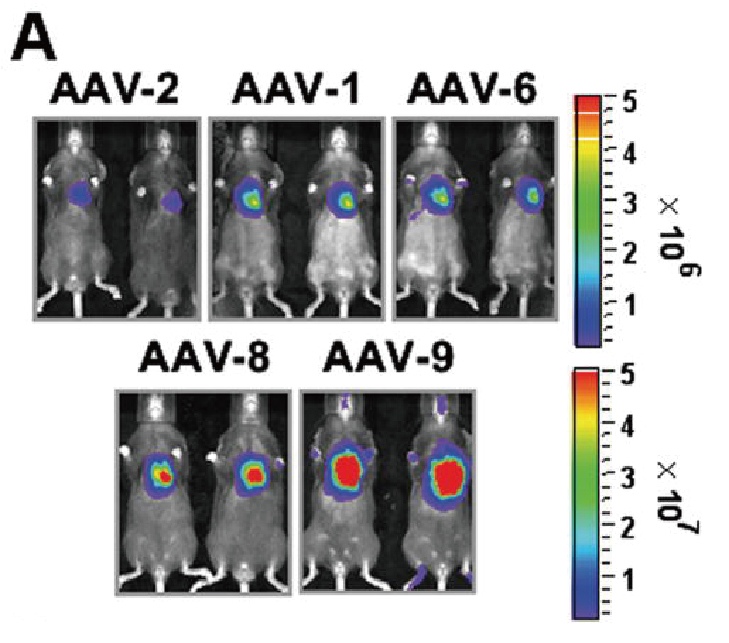
图 五种AAV血清型对心肌细胞特异性基因递送的效率比较(Prasad KM,et al. 2011)。
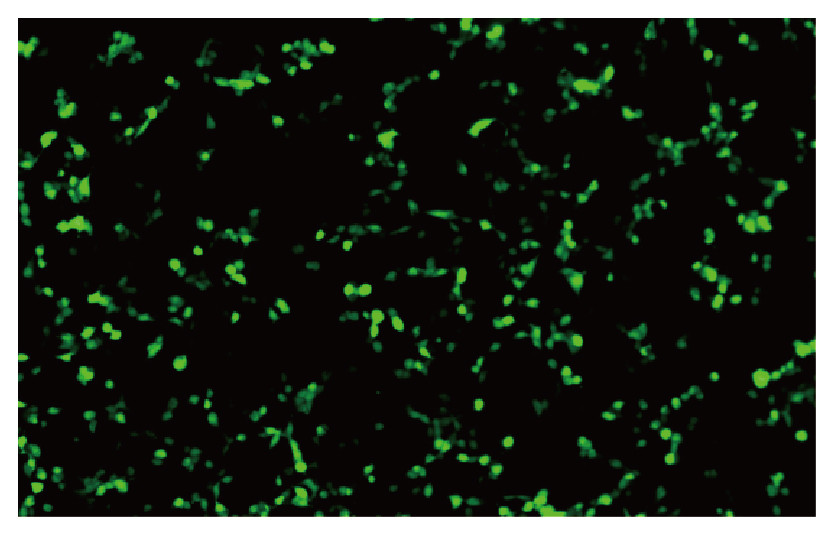
我司AAV2感染细胞效率
参考文献
Hudry E, Vandenberghe LH. Therapeutic AAV Gene Transfer to the Nervous System: A Clinical Reality. Neuron. 2019;101(5):839-862.
Prasad KM, Xu Y, Yang Z, Acton ST, French BA. Robust cardiomyocyte-specific gene expression following systemic injection of AAV: in vivo gene delivery follows a Poisson distribution. Gene Ther. 2011;18(1):43-52.
Wang D, Tai PWL, Gao G. Adeno-associated virus vector as a platform for gene therapy delivery. Nat Rev Drug Discov. 2019;18(5):358-378.
Wang L, Wang H, Bell P, et al. Systematic evaluation of AAV vectors for liver directed gene transfer in murine models. Mol Ther. 2010;18(1):118-125.
我司默认采用三质粒系统进行包毒,若为过表达腺相关病毒包装,则需目的基因在3000bp以内,如有个性化要求,请致电详联