邻近标记
邻近标记
 蛋白实验服务
蛋白实验服务
 组学服务
组学服务
 细胞培养服务
细胞培养服务
 细胞功能检测服务
细胞功能检测服务
 病毒包装服务
病毒包装服务
 外泌体服务
外泌体服务
 检测服务
检测服务
 基因编辑服务
基因编辑服务
 载体构建服务
载体构建服务
 动物实验服务
动物实验服务
 整体实验服务
整体实验服务
 科研绘图
科研绘图
 仪器共享
仪器共享
 伯远知识库
伯远知识库
 下单说明
下单说明
背景说明
基因工程技术,包括基因打靶、基因沉默和转基因技术等首先在小鼠的基因修饰和品系培育上广泛使用,并产生了大量的基因剔除、转基因疾病小鼠模型和基因功能研究模型,成为生命科学研究、医学研究和药学研究的重要支撑条件,并推动了对生命规律的探索和医药研究的发展。
基因工程动物模型包括转基因模型、基因敲除模型、基因敲入模型、基因点突变模型。
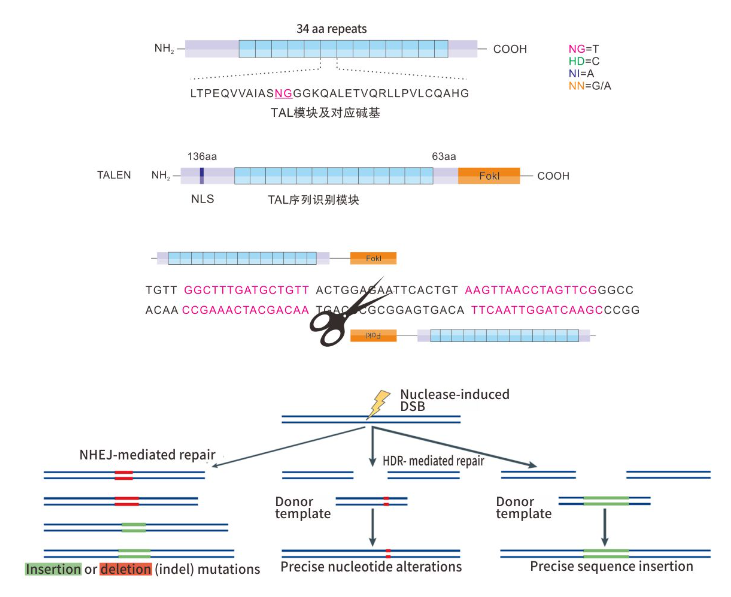
TALEN技术原理
TALEN(Transcription Activator-Like Effector Nuclease)技术是基于对DNA识别的TALEN臂和人工改造的核酸内切酶的切割域(FokⅠ)的结合对细胞基因组进行修饰而实现的。TALEN的DNA识别域是由一些非常保守的重复氨基酸序列模块组成,每个模块由34个氨基酸组成,其中第12和13位的氨基酸种类为可变的(RVDs),且决定了该模块识别靶向位点的特异性。通过DNA识别域结合到靶位点上,以及FokI的切割域形成二聚体后,可特异性对目标基因DNA实现切断。在非同源末端连接修复过程中,DNA双链断开后会由于碱基的随机增减造成目标基因功能缺失。该技术目前已成功应用于植物、细胞、酵母、斑马鱼及大、小鼠等各类模式动物的研究领域。
TALEN技术流程图
TALEN由四部分组成:N端序列,RVD,C端序列,FokI。利用Type II 限制性内切酶可以将RVDs模块分别生成不同的粘性末端,同时又不留有酶切位点,通过一系列的相应酶切连接反应实现RVDs与TALEN骨架的无缝连接。
TALEN系统利用FokI的内切酶活性打断目标基因。FokI形成二聚体发挥活性,在TALEN结合臂的引导下,发挥特异性内切酶活性,在两个靶位点之间剪切DNA,形成DSB(Double-Strand Breaks),诱发DNA损伤修复机制。细胞通过NHEJ(Non-homologous End Joining)修复DNA,在此修饰过程中导致删除或插入了一定数目(非3的倍数)的碱基,造成移码,形成对目标基因特异性KO的突变体。
CRISPR-Cas9技术原理
CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats)是一种来自细菌降解入侵的病毒DNA或其他外源DNA的免疫机制。在细菌及古细菌中,CRISPR系统共分成3类,其中Ⅰ类和Ⅲ类需要多种CRISPR相关蛋白(Cas蛋白)共同发挥作用,而Ⅱ类系统只需要一种Cas蛋白即可,这为其能够广泛应用提供了便利条件。
目前,来自Streptococcus pyogenes的CRISPR-Cas9系统应用最为广泛。Cas9蛋白(含有两个核酸酶结构域),可以分别切割DNA两条单链。Cas9首先与crRNA及tracrRNA结合成复合物,然后通过PAM序列结合并侵入DNA,形成RNA-DNA复合结构,进而对目的DNA双链进行切割,使DNA双链断裂。
由于PAM序列结构简单(5'-NGG-3’),几乎可以在所有的基因中找到大量靶点,因此得到广泛的应用。CRISPR-Cas9系统已经成功应用于植物、细菌、酵母、鱼类及哺乳动物细胞,是目前最高效的基因组编辑系统。