


背景说明
现有的基因编辑系统主要包括锌指核酸酶(Zinc finger nucleases,ZFNs)系统、类转录激活因子效应物核酸酶(Transcription activator-like effector nucleases,TALENs)系统以及CRISPR/Cas(Clustered regularly interspaced short palindromic repeat-associated protein)系统,其中,CRISPR/Cas系统由于载体构建过程简单、编辑效率高等优点,成为当前广泛应用的主流基因编辑系统。2020年,Emmanuelle Charpentier和Jennifer A. Doudna两位科学家获得了诺贝尔化学奖,以表彰她们在“开发CRISPR/Cas基因组编辑方法”方面作出的贡献。

图 CRISPR/Cas9基因编辑工具的发展历程(Zhang H, et al. 2021)。
原理简介
CRISPR/Cas系统分为两大类五种类型(Ⅰ-Ⅴ),目前应用较广的CRISPR/Cas9系统为Ⅱ型CRISPR系统,仅需一个Cas蛋白和两个RNA元件即可实现对靶DNA的切割。为了进一步简化CRISPR/Cas9系统,通过保留必需元件tracrRNA和crRNA的核心序列并引入连接区,将两者合并为一个sgRNA(Single guide RNA),并通过体外实验证实Cas9蛋白能在sgRNA的引导下切割双链DNA,这一系列成果为CRISPR/Cas9在基因编辑中的广泛应用奠定了坚实基础。自2013年起,利用CRISPR/Cas9技术相继实现了对人类细胞、小鼠细胞、斑马鱼、果蝇、水稻、拟南芥等真核系统中的内源基因组编辑。
来源于链球菌Streptococcus pyogenes的Cas9蛋白SpCas9最先被应用于基因编辑,该蛋白含有一个RuvC-like结构域和一个HNH核酸酶结构域,两者分别在靶DNA的PAM序列“NGG”上游3nt处对DNA双链进行切割,形成平末端。在真核系统中,需要在Cas9蛋白中添加一段核定位信号以保证该蛋白进入细胞核正常发挥功能。sgRNA是一段具有特定结构的单链RNA,其5’端约20个碱基与靶DNA互补配对结合,引导Cas9/sgRNA复合物对相应位点进行切割,决定编辑位点特异性。因此,在构建基因编辑载体编辑受体基因组中不同的位点时,只须改变sgRNA中5’端的特异位点识别序列,而其他元件可保持不变。此外,通过构建多个sgRNA表达盒的串联载体,可实现同时对多个靶位点的有效编辑,显著地提高该系统的编辑效率。在基因编辑载体构建完成后,体外导入细胞的有效方法有病毒感染和非病毒(电穿孔、核转染、显微注射或纳米颗粒)两种方法。
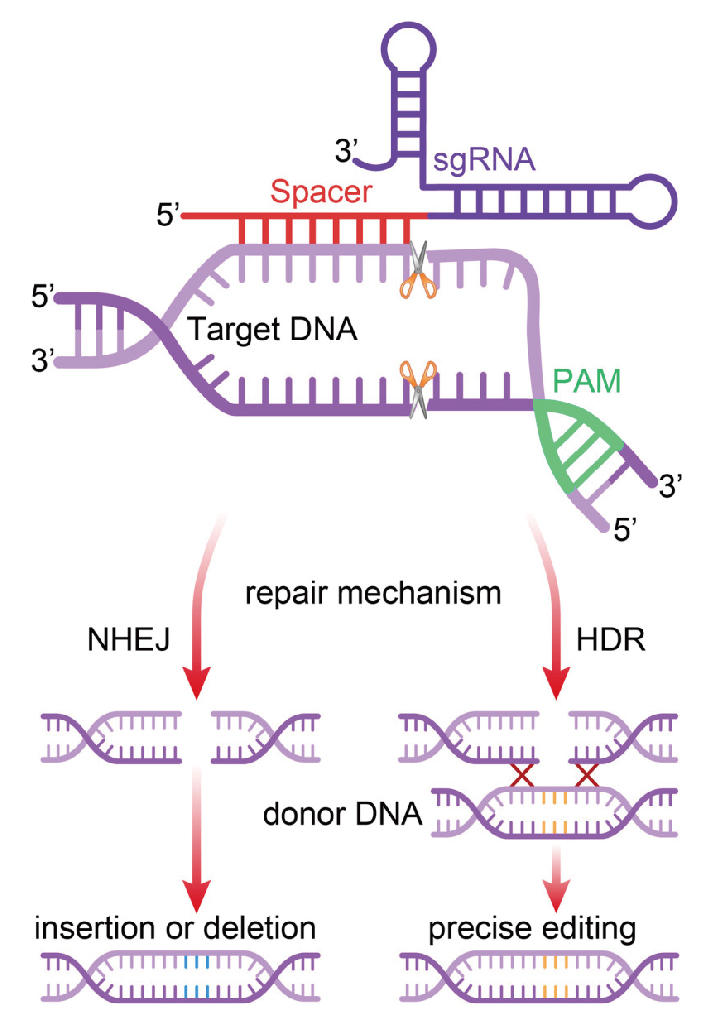
图 CRISPR/Cas9基因编辑系统机制(Zhang H, et al. 2021)。
我司载体介绍
我司基因编辑载体大多采用商品化载体,部分载体为我司改造。我司可针对您的目的基因序列,分析序列的各项参数后,设计引物后扩增预期片段,连入原始载体骨架,得到重组载体。
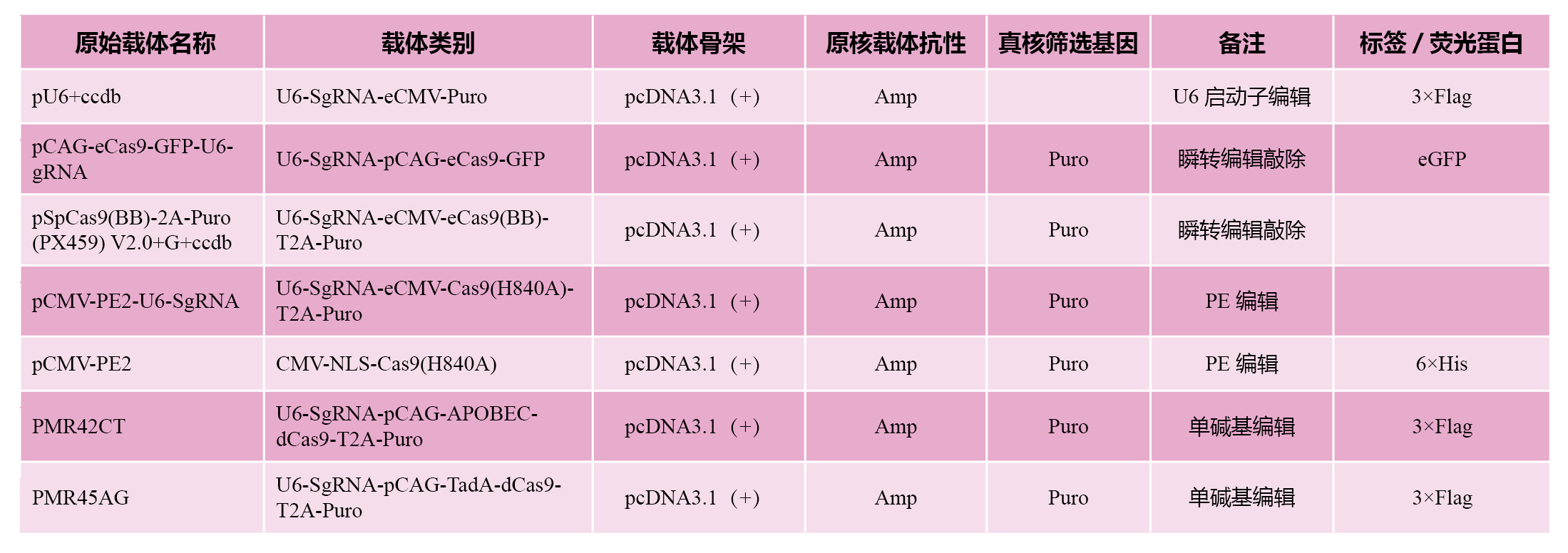
我司原始细胞基因编辑载体列表,可根据不同的需求,选择不同的载体,插入不同的位置
服务流程
客户在线下单——订单/实验材料确认——CloneCAD实验设计——基因编辑载体构建——可选后续实验(包括:细胞转染/感染、体内注射、功能研究等等)——结果交付
服务内容及说明
适用范围
1、功能基因的敲除/敲入;
2、非编码区的编辑,例如对启动子、microRNA、lncRNA、circRNA的基因序列进行编辑;
3、单碱基编辑(敲除/敲入)、精准碱基编辑;
4、非同源/同源多基因敲除、代谢通路多基因敲除;
5、大片段删除;
6、基因定点突变/修饰。
客户下单及项目信息填写
在我司官网http://www.biorun.com/进行注册或登录,请客户按照页面提示填写:目的基因信息、载体构建详情,后续转染的细胞可选自行提供或我司提供。
实验信息
实验过程中客户可以随时登入管理系统查看项目实时进展情况。实验结题时系统会通过短信自动通知客户,并发送实验报告查看网址。实验结题后,实验报告、检测结果可在线查看或打印,并永久保留。
实验周期
致电详询
实验交付内容
1、所有实验的原始数据(包括实验过程、实验试剂与设备等);
2、重组过表达载体:一份质粒、一份大肠杆菌菌液(25%甘油菌);
3、重组载体的全序列信息和注释信息;
4、重组载体的酶切图谱;
5、重组载体测序结果;
6、后续所有实验的相关结果(靶点三包一至少有效果)。
案例展示
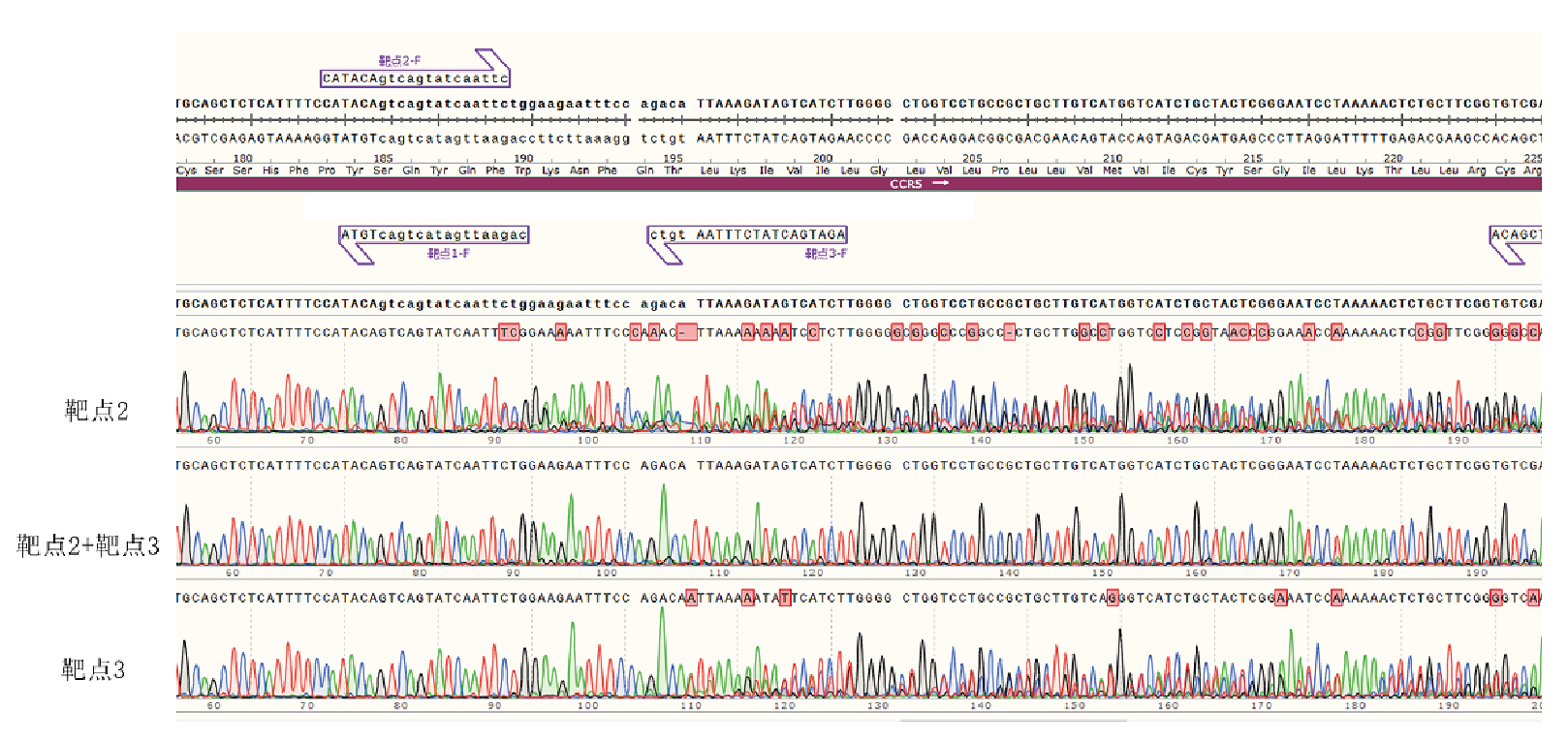
图 我司HeLa细胞中xx基因单靶点与双靶点敲除检测示意图
参考文献
Zhang H, Qin C, An C, et al. Application of the CRISPR/Cas9-based gene editing technique in basic research, diagnosis, and therapy of cancer. Mol Cancer. 2021;20(1):126.