

背景说明
通常,LVs是通过反式互补产生的,其表达系统由用于表达特定基因的目的质粒及病毒gag/pol、Rev和VSVG等组分的包装质粒组成,其中包装质粒提供了病毒基因组mRNA包装成完整毒粒所必需的结构蛋白、聚合酶和包膜蛋白。
LVs具有感染谱广泛、可以有效感染分裂期和静止期细胞、长期稳定表达外源基因等优点,区别于一般的逆转录病毒载体,其对分裂细胞和非分裂细胞均具有感染能力。携带有外源基因的LVs在慢病毒包装质粒、细胞系的辅助下,经过病毒包装成为有感染力的病毒颗粒,通过感染细胞或活体组织,实现外源基因在细胞或活体组织中表达。
通常根据不同的实验目的针对LVs改造以进行启动子活性研究、基因表达研究、基因沉默等研究。外源基因则通过载体中的多克隆位点插入LVs以进行表达。
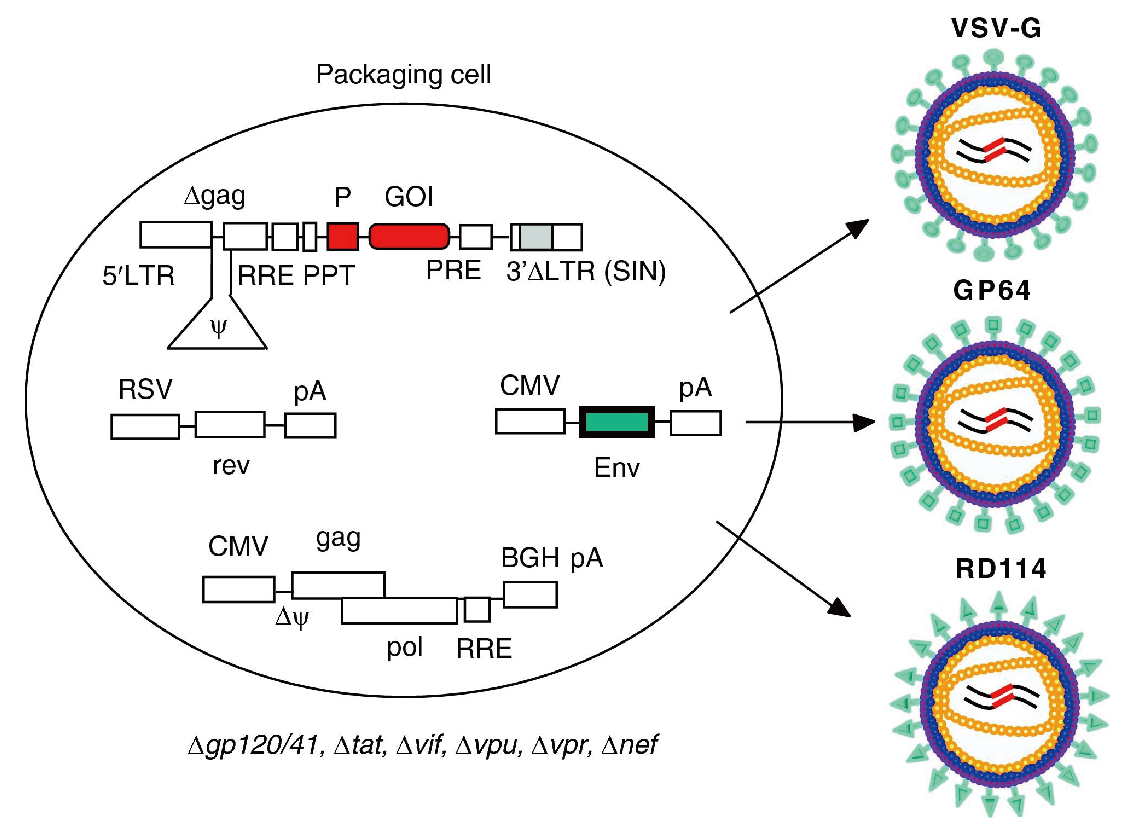
图 反式互补生产LVs(Mátrai et al. 2010)。
原理简介
携带有外源基因的LVs在慢病毒包装质粒、细胞系的辅助下,经过病毒包装成为有感染力的病毒颗粒,通过感染细胞或活体组织,实现外源基因在细胞或活体组织中表达。
LVs包含了包装、转染、稳定整合所需要的遗传信息。慢病毒包装质粒可提供所有的转录,并包装RNA到重组的假病毒载体所需要的所有辅助蛋白。为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子。
通常根据不同的实验目的针对LVs改造以进行启动子活性研究、基因表达研究、基因沉默等研究。外源基因则通过载体中的多克隆位点插入LVs以进行表达。
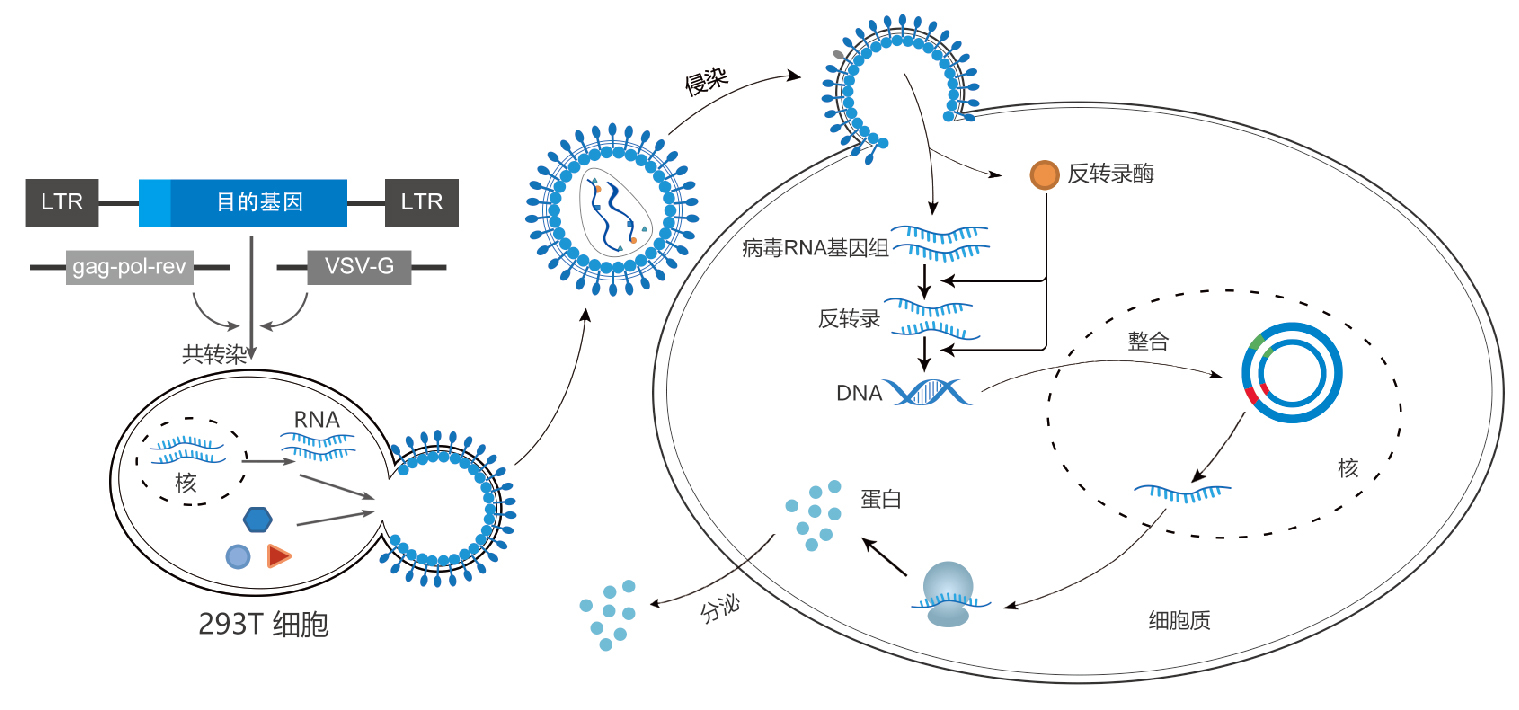
图 慢病毒包装和侵染过程示意图
我司载体简介
我司可提供丰富的LVs产品体系,用于操作编码基因和非编码基因,如lncRNA、miRNA、circRNA。
我司原始细胞慢病毒包装载体列表,可根据不同的需求,选择不同的载体,插入不同的位置
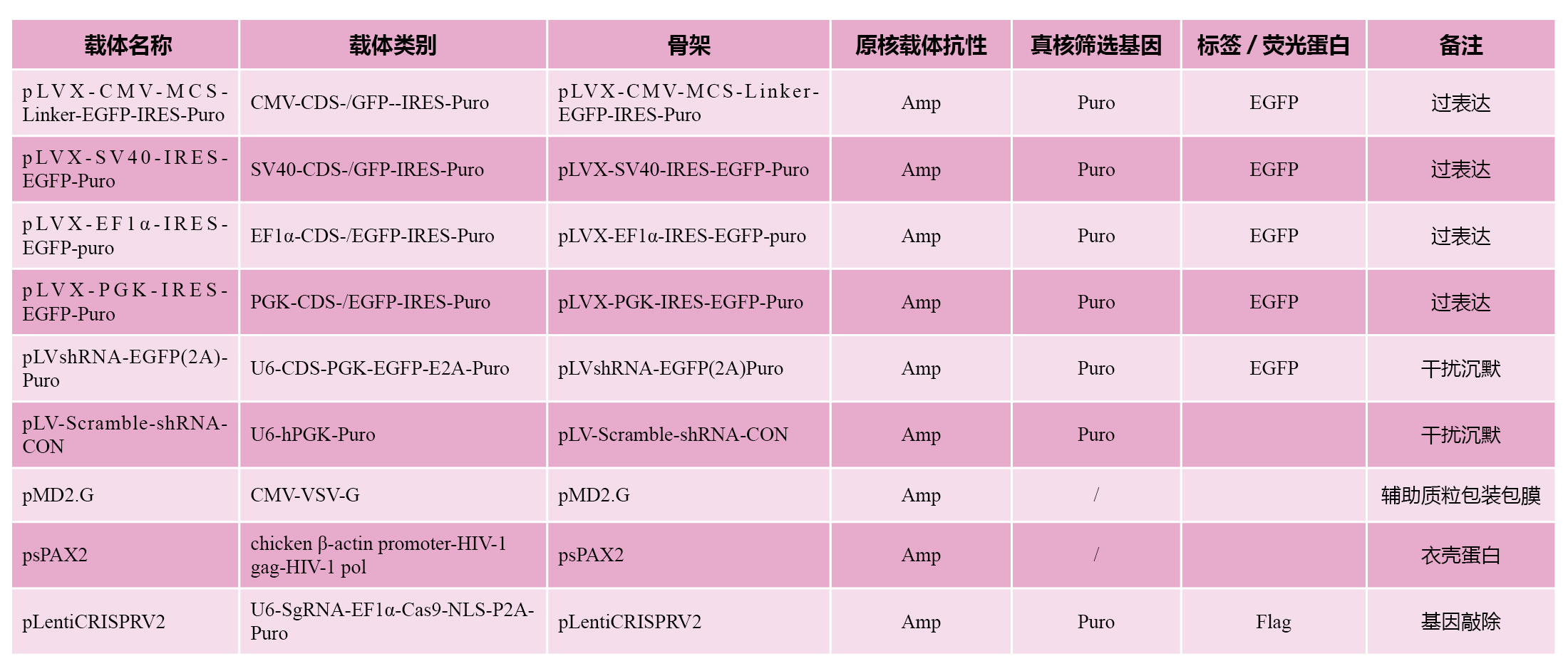
服务内容及说明
慢病毒滴度鉴定方法
|
检测项目 |
原理 |
优点 |
缺点 |
|
GEP荧光计数 |
流式细胞计数 |
经典方法,重复性好; 检测活性病毒感染滴度 |
仪器和操作要求高; 操作复杂 |
|
绝对定量qPCR |
病毒感染工具细胞后,抽提整合目的片段的细胞基因组DNA,与标准品比较 |
检测活性病毒感染滴度; 最接近真实滴度 |
仪器和操作要求高; 操作复杂 |
|
RT-qPCR |
病毒梯度稀释感染工具细胞后,抽提RNA,RT-qPCR检测病毒基因组表达 |
检测活性病毒感染滴度 |
受限于病毒感染后检测基因表达丰度 |
|
p24核心蛋白ELISA定量 |
对慢病毒颗粒稳定表达的p24蛋白进行ELISA检测 |
简单、快捷、重复性好 |
反映的是病毒物理颗粒数不是活性滴度 |
适用范围
现在LV系统已经被广泛应用到各种细胞系的基因过表达、RNA干扰、miRNA研究以及活体动物实验中。
客户下单及项目信息填写
在我司官网http://www.biorun.com/进行注册或登录,请客户按照页面提示填写:目的基因信息、载体构建详情,后续感染的细胞可选自行提供或我司提供。
实验信息
实验过程中客户可以随时登入管理系统查看项目实时进展情况。实验结题时系统会通过短信自动通知客户,并发送实验报告查看网址。实验结题后,实验报告、检测结果可在线查看或打印,并永久保留。
实验周期
致电详询
实验交付内容
1、所有实验的原始数据(包括实验过程、实验试剂与设备等);
2、重组载体的全序列信息和注释信息;
3、重组载体的酶切图谱;
4、重组载体测序结果;
5、引物序列;
6、病毒质控鉴定报告与结果分析(包含滴度鉴定、BCA检测、支原体检测等可选);
7、高滴度慢病毒载体(不低于108TU/mL);
8、阴性对照病毒;
9、稳转细胞株(可选)。
案例展示
1、慢病毒感染细胞效率实例
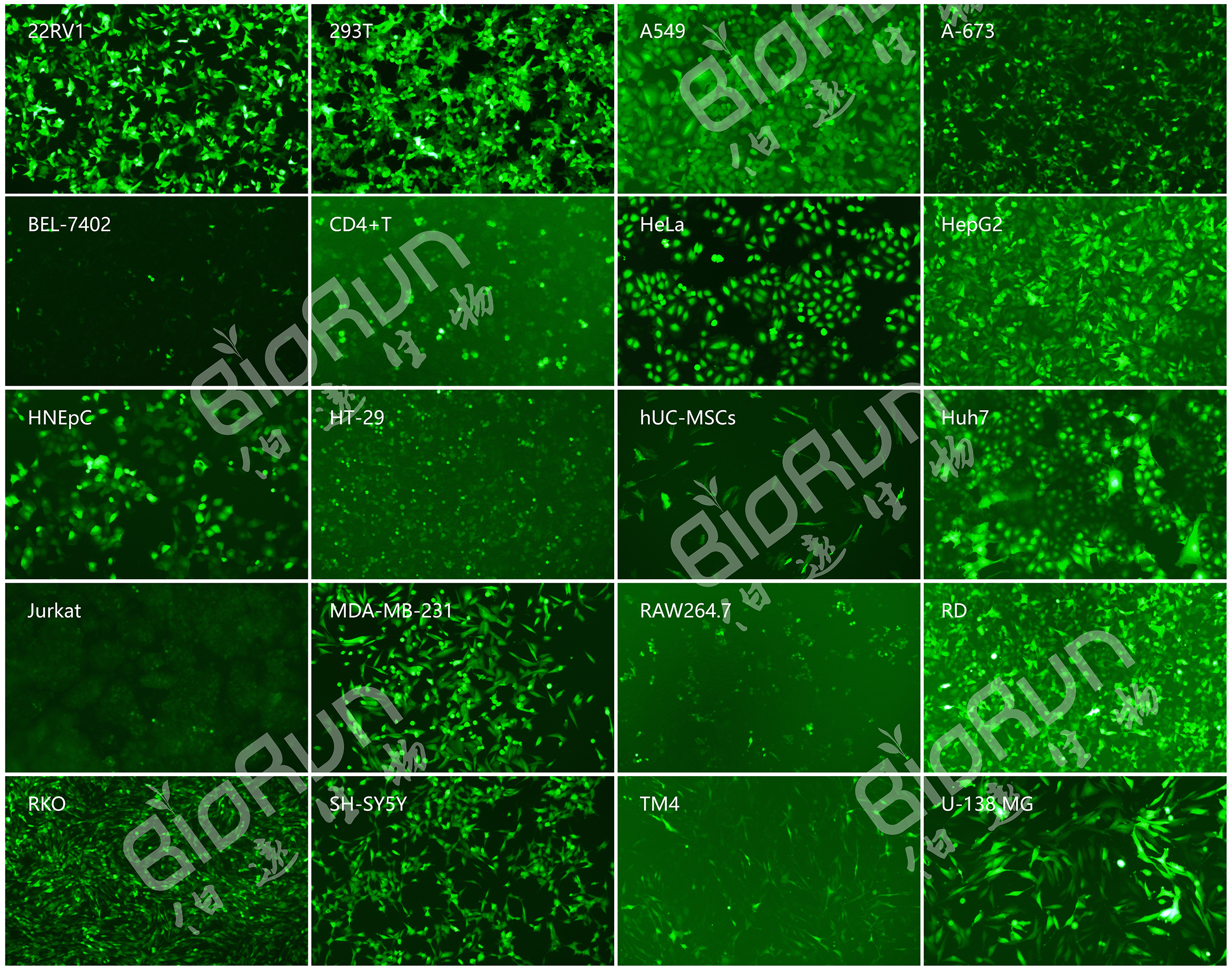
图 慢病毒感染细胞效率
2、慢病毒体内表达应用实例
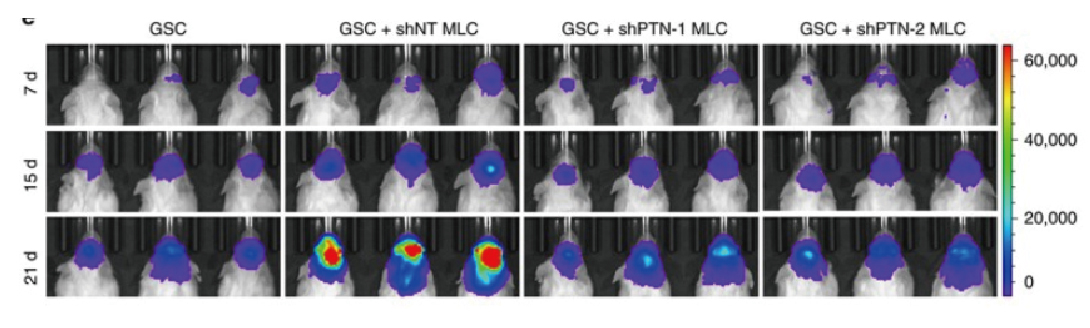
图 慢病毒体内表达应用实例(Shi Y, et al. 2017)。
参考文献
Mátrai J, Chuah MK, VandenDriessche T. Recent advances in lentiviral vector development and applications. Mol Ther. 2010;18(3):477-490.
Shi Y, Ping YF, Zhou W, et al. Tumour-associated macrophages secrete pleiotrophin to promote PTPRZ1 signalling in glioblastoma stem cells for tumour growth. Nat Commun. 2017;8:15080.